Johan Akvist, ricercatore dell'Università di Wallenberg, rivolge la sua curiosità verso organismi che potrebbero vivere vicino a vulcani caldi o nelle profondità dei mari ghiacciati. Con l'aiuto di grandi calcoli al computer, ha simulato l'attività enzimatica nelle cellule degli organismi viventi. L’obiettivo è capire come sono riusciti ad adattarsi ad ambienti così difficili.

Il mondo di Wallenberg
istituzione:
Università di Uppsala
Campo di ricerca:
Progettazione di enzimi basata su computer
La vita sulla Terra non prospera solo nei climi temperati con un buon accesso all’ossigeno e alle sostanze nutritive. Se guardiamo agli ambienti estremi come i vulcani attivi o le fosse profonde, anche lì troverai molta vita.
Gli organismi che prosperano in luoghi estremamente caldi o freddi, o in ambienti ad alta pressione o acidi, sono chiamati estremofili. Si tratta soprattutto di batteri, ma anche i pesci prosperano, anche se la temperatura dell'acqua può avvicinarsi allo zero.
– Ciò che questi organismi hanno in comune è che non hanno modo di regolare la temperatura corporea, hanno al loro interno la stessa temperatura dell'ambiente. La domanda è come gli enzimi e le proteine possano funzionare in queste condizioni estreme, afferma Johan Akvist, professore di chimica teorica all'Università di Uppsala e ricercatore di Wallenberg.
Gli enzimi del corpo possono essere paragonati alle piccole macchine che mantengono attivo il metabolismo in tutte le cellule viventi. Ma negli esseri umani e in altri mammiferi gli enzimi funzionano solo nelle giuste condizioni, ad esempio il meccanismo cellulare si ferma quando la temperatura corporea scende troppo.
Sorprendentemente, le differenze sono poche
Come uno dei ricercatori di Wallenberg, Johan Akvist si concentra sulla mappatura delle differenze tra i nostri enzimi e quelli degli estremofili. Finora, sorprendentemente, ne sono stati trovati pochi.
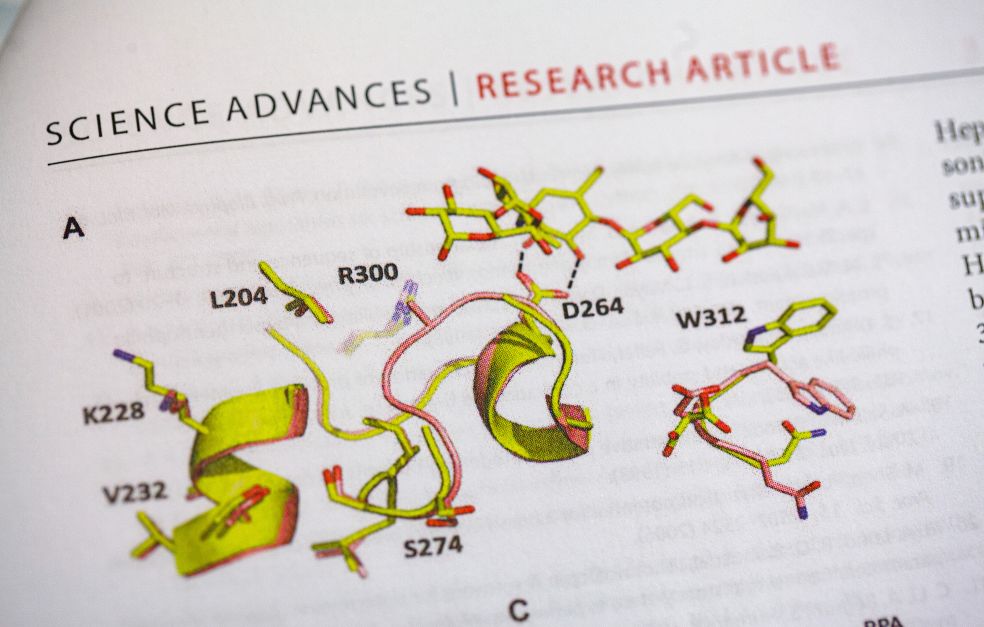
Sorprendentemente, la maggior parte delle differenze che abbiamo riscontrato riguardavano la superficie dell'enzima. Piccole differenze nella struttura superficiale determinano se un enzima può continuare a funzionare anche in condizioni estreme.
Si gira verso lo schermo del computer per visualizzare le immagini di uno specifico enzima presente in due diversi tipi di batteri. Un batterio viene prelevato dall'Oceano Artico e l'altro vive nel nostro clima temperato. Quando sintetizza le immagini strutturali dell'enzima, non c'è quasi alcuna differenza tra loro.
Questi due enzimi sono essenzialmente identici, ad eccezione di alcuni punti sulla superficie. La spiegazione della differenza è che durante l’evoluzione si sono verificate una serie di mutazioni che hanno conferito all’enzima adattato al freddo le sue nuove proprietà.
La borsa di studio mi dà l'opportunità di capire cosa conferisce a diversi enzimi proprietà così diverse. Questo in un'istituzione che ha un mix di competenze e campi che ha creato un ambiente molto fertile.
In poche parole, l'evoluzione ha reso la superficie dell'enzima più morbida. Grazie alla superficie liscia, l'enzima può mantenere la sua funzione, o velocità di reazione, anche se la temperatura scende a zero.
La velocità di una reazione enzimatica è controllata da una barriera energetica che deve essere superata prima che l'enzima possa catalizzare le reazioni nella cellula. La dimensione della barriera energetica è determinata dalla quantità di energia richiesta per la reazione e dalla quantità di ordine che deve essere prima creato nell'ambiente. Due quantità sono indicate con i termini entalpia ed entropia. Gli enzimi con una superficie più morbida hanno la capacità di modificare l'equilibrio tra queste quantità in modo che possano funzionare anche nelle condizioni più difficili.
Ampie simulazioni al computer
La scoperta è stata fatta utilizzando estese simulazioni al computer di come gli enzimi selezionati si comportano in diverse condizioni. Le simulazioni sono state rese possibili dalla mappatura effettuata negli ultimi decenni delle strutture atomiche 3D di centinaia di migliaia di enzimi diversi. Per riuscire nella simulazione, è necessario anche l'accesso all'enorme potenza di calcolo ospitata nella rete di supercomputer NAISS, l'infrastruttura accademica nazionale dei supercomputer svedese.
– Utilizzando metodi di simulazione su larga scala, possiamo calcolare qualsiasi cosa, dalla velocità della reazione enzimatica alla forza di legame, all'energia di attivazione, alla temperatura di fusione e altro ancora, afferma Johan Akvist.
Le simulazioni consentono la previsione delle mutazioni che sono alla base della capacità adattativa degli enzimi. I risultati dei calcoli vengono poi confermati da esperimenti biochimici in laboratorio.
– Per la prima volta possiamo spiegare come diverse mutazioni influenzano la capacità degli enzimi di adattarsi. Siamo tra i primi a riuscirci simulando le reazioni attraverso grandi calcoli al computer. È un metodo che ci rende molto più veloci degli attuali metodi sperimentali, afferma Johan Akvist.
Molte applicazioni diverse
Il campo della progettazione di enzimi computerizzati è cresciuto in modo significativo negli ultimi anni ed è oggi un’area calda di ricerca. La capacità di produrre enzimi con nuove proprietà è importante, soprattutto nell’industria farmaceutica, che ha bisogno di nuovi modi per sviluppare farmaci con maggiore precisione e in tempi più brevi.
Enzimi appositamente progettati possono essere utilizzati anche per qualsiasi cosa, dalla produzione di biocarburanti alla scomposizione di varie tossine ambientali presenti in natura. Un esempio quotidiano di ciò è la produzione di detersivi che sono efficaci sia in acqua fredda che in acqua calda.
Johan Akvist è stato tra i primi in Svezia a sviluppare metodi computazionali nel campo della dinamica molecolare. Durante i suoi studi di dottorato negli anni '80, ha lavorato su metodi per calcolare la velocità di reazione degli enzimi in base alla loro struttura tridimensionale. Rimane guidato dalla curiosità e dal desiderio di contribuire allo sviluppo di nuove tecnologie.
– Oggi voglio capire cosa ha fatto l'evoluzione per far funzionare tutto questo. Inoltre, voglio contribuire alla possibilità di progettare enzimi con proprietà uniche.
Invia un messaggio di testo a Magnus Trogen Bahlen
Foto di Magnus Bergström